Учебно-справочный
материал: параграф №6
| Номер
параграфа: 6 |
| Тема:
Кинематика химических реакций. |
| Разделы:
Скорость химических реакций. Факторы,
влияющие на скорость химических
реакций. Закон действующих масс (К.
Гульдберг, П.Вааге, 1867г.).
Химическое равновесие. Способы
смещения равновесия. |
Скорость
химических реакций.
Скорость
реакции определяется изменением
молярной концентрации одного из
реагирующих веществ:
V = ± ((С2 - С1) / (t2
- t1)) = ± (DС
/ Dt)
где С1 и С2 - молярные
концентрации веществ в моменты
времени t1 и t2
соответственно (знак (+) - если
скорость определяется по продукту
реакции, знак (-) - по исходному
веществу).
Реакции происходят при
столкновении молекул реагирующих
веществ. Ее скорость определяется
количеством столкновений и
вероятностью того, что они приведут к
превращению. Число столкновений
определяется концентрациями
реагирующих веществ, а вероятность
реакции - энергией сталкивающихся
молекул.

Факторы,
влияющие на скорость химических
реакций.
1. Природа реагирующих веществ.
Большую роль играет характер
химических связей и строение молекул
реагентов. Реакции протекают в
направлении разрушения менее
прочных связей и образования веществ
с более прочными связями. Так, для
разрыва связей в молекулах H2 и N2
требуются высокие энергии; такие
молекулы мало реакционноспособны.
Для разрыва связей в сильнополярных
молекулах (HCl, H2O) требуется
меньше энергии, и скорость реакции
значительно выше. Реакции между
ионами в растворах электролитов
протекают практически мгновенно.
Примеры.
Фтор с водородом
реагирует со взрывом при комнатной
температуре, бром с водородом
взаимодействует медленно и при
нагревании.
Оксид кальция вступает в
реакцию с водой энергично, с
выделением тепла; оксид меди - не
реагирует.
2. Концентрация. С
увеличением концентрации (числа
частиц в единице объема) чаще
происходят столкновения молекул
реагирующих веществ - скорость
реакции возрастает.

Закон
действующих масс (К. Гульдберг, П.Вааге,
1867г.).
Скорость химической
реакции прямо пропорциональна
произведению концентраций
реагирующих веществ.
aA + bB + . . . ®
. . .
V = k • [A]a
• [B]b • . . .
Константа скорости
реакции k зависит от природы
реагирующих веществ, температуры и
катализатора, но не зависит от
значения концентраций реагентов.
Физический смысл
константы скорости заключается в том,
что она равна скорости реакции при
единичных концентрациях реагирующих
веществ.
Для гетерогенных реакций
концентрация твердой фазы в
выражение скорости реакции не входит.
3. Температура. При
повышении температуры на каждые 10°C
скорость реакции возрастает в 2-4 раза
(Правило Вант-Гоффа). При увеличении
температуры от t1 до t2
изменение скорости реакции можно
рассчитать по формуле:
|
(t2
- t1) / 10
|
|
Vt2 / Vt1 = g
|
|
(где Vt2 и Vt1
- скорости реакции при температурах t2
и t1 соответственно; g-
температурный коэффициент данной
реакции).
Правило Вант-Гоффа
применимо только в узком интервале
температур. Более точным является
уравнение Аррениуса:
k = A • e -Ea/RT
где
A - постоянная, зависящая от природы
реагирующих веществ;
R - универсальная газовая
постоянная [8,314 Дж/(моль o К) = 0,082 л o атм/(моль
o К)];
Ea - энергия активации, т.е. энергия,
которой должны обладать
сталкивающиеся молекулы, чтобы
столкновение привело к химическому
превращению.
Энергетическая диаграмма
химической реакции.
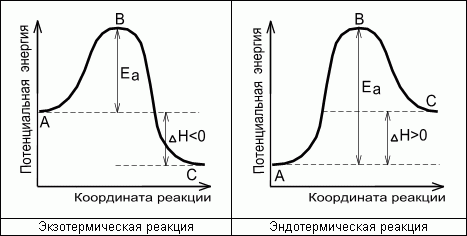
А - реагенты, В -
активированный комплекс (переходное
состояние), С - продукты.
Чем больше энергия
активации Ea, тем сильнее возрастает
скорость реакции при увеличении
температуры.
4. Поверхность
соприкосновения реагирующих веществ.
Для гетерогенных систем (когда
вещества находятся в разных
агрегатных состояниях), чем больше
поверхность соприкосновения, тем
быстрее протекает реакция.
Поверхность твердых веществ может
быть увеличена путем их измельчения,
а для растворимых веществ - путем их
растворения.
5. Катализ. Вещества, которые
участвуют в реакциях и увеличивают
ее скорость, оставаясь к концу
реакции неизменными, называются
катализаторами. Механизм действия
катализаторов связан с уменьшением
энергии активации реакции за счет
образования промежуточных
соединений. При гомогенном катализе
реагенты и катализатор составляют
одну фазу (находятся в одном
агрегатном состоянии), при
гетерогенном катализе - разные фазы (находятся
в различных агрегатных состояниях).
Резко замедлить протекание
нежелательных химических процессов
в ряде случаев можно добавляя в
реакционную среду ингибиторы (явление
"отрицательного катализа").

Химическое
равновесие.
Обратимые реакции -
химические реакции, протекающие
одновременно в двух противоположных
направлениях.
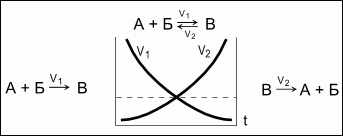
Химическое равновесие
- состояние системы, в котором
скорость прямой реакции (V1) равна
скорости обратной реакции (V2).
При химическом равновесии
концентрации веществ остаются
неизменными. Химическое равновесие
имеет динамический характер: прямая
и обратная реакции при равновесии не
прекращаются.
Состояние химического
равновесия количественно
характеризуется константой
равновесия, представляющей собой
отношение констант прямой (K1) и
обратной (K2) реакций.
Для реакции mA + nB <-> pC +
dD константа равновесия равна
K = K1 / K2 = ([C]p
• [D]d) / ([A]m • [B]n)
Константа равновесия
зависит от температуры и природы
реагирующих веществ. Чем больше
константа равновесия, тем больше
равновесие сдвинуто в сторону
образования продуктов прямой
реакции.

Способы
смещения равновесия.
Принцип Ле-Шателье.
Если на систему, находящуюся в
равновесии, производится внешнее
воздействие (изменяются
концентрация, температура, давление),
то оно благоприятствует протеканию
той из двух противоположных реакций,
которая ослабляет это воздействие
1. Давление. Увеличение давления
(для газов) смещает равновесие в
сторону реакции, ведущей к
уменьшению объема (т.е. к образованию
меньшего числа молекул).
|
V1
|
|
|
|
A + Б
|
<-> |
В |
;
увеличение P приводит к V1
> V2 |
|
V2 |
|
|
|
2
|
|
1
|
|
2. Увеличение температуры смещает
положение равновесия в сторону
эндотермической реакции (т.е. в
сторону реакции, протекающей с
поглощением теплоты)
|
V1
|
В + Q, то
увеличение t°C приводит к V2
> V1
|
|
A + Б
|
<-> |
|
V2 |
|
V1
|
В - Q, то
увеличение t°C приводит к V1
> V2
|
|
A + Б
|
<-> |
|
V2 |
3. Увеличение концентрации исходных
веществ и удаление продуктов из
сферы реакции смещает равновесие в
сторону прямой реакции. Увеличение
концентраций исходных веществ [A] или
[Б] или [А] и [Б]: V1 > V2.
4. Катализаторы не влияют на
положение равновесия.
|

